Bài 1: Chọn định nghĩa đúng tốt nhất về liên kết cộng hóa trị.
Bạn đang xem: Giải bài tập hóa nâng cao 10
Liên kết cùng hóa trị là liên kết
A. Giữa những phi kim với nhau.
B. Trong các số ấy cặp electron bình thường bị lệch về một nguyên tử.
C. được hình thành vị sự dùng thông thường electron của 2 nguyên tử khác nhau.
D. được có mặt giữa nhì nguyên tử bằng một hay các cặp electron chung.
Chọn D.
Bài 2: tử (CH_4) , thân nguyên tử O và các nguyên tử H vào phân tử (H_2O), giữa nguyên tử S và những nguyên tử H trong phân tử (H_2S).
– vào phân tử (CH_4), nguyên tử cacbon ném ra 4 electron phần ngoài cùng chế tạo thành 4 cặp electron bình thường với 4 nguyên tử hiđro. Từng nguyên tử vào phân tử (CH_4) đều có được cấu hình chắc chắn của nguyên tử khí hiếm sát nhất: mỗi nguyên tử hiđro tất cả 2 electron (giống He), còn nguyên tử cacbon có 8 electron lớp ngoài cùng (giống Ne).
– trong phân tử (H_2O), nguyên tử oxi ném ra 2 electron phần bên ngoài cùng tạo thành 2 cặp electron phổ biến với 2 nguyên tử hiđro. Từng nguyên tử vào phân tử (H_2O) đều đạt được cấu hình bền bỉ của nguyên tử khí hiếm ngay sát nhất: từng nguyên tử hiđro có 2 electron (giống He), còn nguyên tử oxi có 8 electron phần bên ngoài cùng (giống Ne).
Xem thêm: Cách Tạo Bọt Sữa Rửa Mặt - 3 Hiệu Quả, Tốt (Rất Cần Thiết)
– trong phân tử (H_2S), nguyên tử lưu huỳnh ném ra 2 electron lớp ngoài cùng sinh sản thành 2 cặp electron tầm thường với 2 nguyên tử hiđro. Từng nguyên tử trong phân tử (H_2S) đều đạt được cấu hình bền bỉ của nguyên tử khí hiếm ngay gần nhất: từng nguyên tử hiđro gồm 2 electron (giống He), còn nguyên tử lưu lại huỳnh bao gồm 8 electron phần bên ngoài cùng.
Bài 3: Giải yêu thích sự hình thành cặp electron link giữa nhì nguyên tử N vào phân tử (N_2), thân nguyên tử H cùng nguyên tử Cl trong phân tử HCl.
– vào phân tử (N_2) , mỗi nguyên tử nitơ bỏ ra 3 electron phần ngoài cùng chế tạo thành 3 cặp electron chung giữa hai nguyên tử nitơ. Mỗi nguyên tử vào phân tử (N_2) đều giành được cấu hình bền bỉ của nguyên tử khí hiếm gần nhất: mỗi nguyên tử nitơ bao gồm 8 electron phần bên ngoài cùng.
– vào phân tử HCl, nguyên tử clo bỏ ra 1 electron phần bên ngoài cùng chế tác thành 1 cặp electron chung với một nguyên tử hiđro. Mỗi nguyên tử trong phân tử HCl đều giành được cấu hình bền chắc của nguyên tử khí hiếm gần nhất: mỗi nguyên tử hiđro có 2 electron (giống He), còn nguyên tử clo bao gồm 8 electron phần bên ngoài cùng.
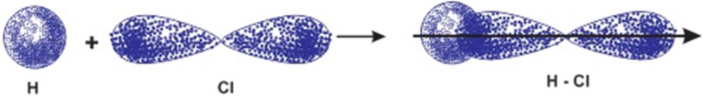
Bài 4: Giải ham mê sự hình thành link cộng hóa trị bởi sự xen phủ những obitan vào phân tử HCl.
Liên kết chất hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xen phủ giữa obitan 1s của nguyên tử hiđro cùng obitan 3p có một electron đơn lẻ của nguyên tử clo.
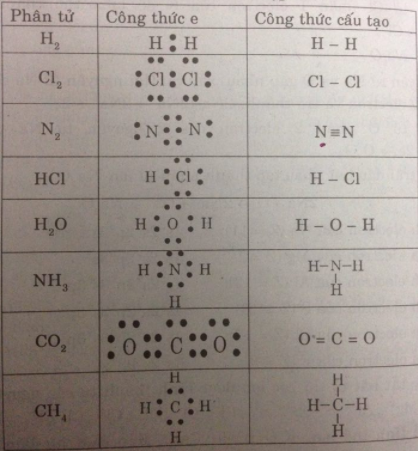
Bài 5: Hãy viết cách làm electron cùng công thức cấu tạo của những phân tử sau đây:
(H_2,HCl,H_2O,Cl_2,NH_3,CH_4.)
Bài 6: X, Y, Z là những nguyên tố gồm số đơn vị chức năng điện tích phân tử nhân là 9, 19, 8.
a) Viết thông số kỹ thuật electron nguyên tử những nguyên tố đó.
b) dự đoán kiểu link hóa học có thể có giữa những cặp X cùng Y, Y cùng Z, Z và X.
a) thông số kỹ thuật electron nguyên tử là:
(eqalign& X,left( Z = 9 ight):,,1s^22s^22p^5 cr& Yleft( Z = 19 ight):,,1s^22s^22p^63s^23p^64s^1 cr& Zleft( Z = 8 ight):,,1s^22s^22p^4 cr )



